🖇️ El largo camino a la simbiosis
Parte 3 de la serie «🦠 Bacterias: máquinas que dominan el universo»

Se acepta comúnmente que las bacterias producen multitud de enfermedades en plantas, animales y humanos.
También sabemos que en nuestro cuerpo, tanto fuera como dentro, viven billones de bacterias; y sabemos que son esenciales para la vida humana. ¿Por qué nos enfocamos tanto en la enfermedad?
⚡ Replicación rápida
Una característica interesante de las bacterias (y que da bastante miedo) es lo rápido que son capaces de reproducirse.
El tiempo de replicación de las bacterias típicas en el laboratorio puede oscilar entre unos 20 minutos para Escherichia coli y 15 horas para Mycobacterium tuberculosis. En la naturaleza se observan tiempo de replicación mayores, alrededor de una hora para E. coli. En el tiempo en el que un mamífero particularmente prolífico madura y procrea, unas 12 semanas para un ratón, estas bacterias se habrán duplicado unas 2000 veces.
Esta velocidad de replicación implica que las bacterias pueden evolucionar muy rápido. ¿Cómo de rápido? Este increíble vídeo muestra cómo evoluciona una cepa bacteriana en pocas horas para conseguir inmunidad ante un antibiótico.
⏳ Evolución a largo plazo
¿Qué pasa cuando se suceden muchas generaciones de bacterias? ¿A dónde pueden llegar?
En 1988 un joven Richard Lenski empezó un novedoso experimento: observar la evolución de E. coli a largo plazo. Esta bacteria es la favorita de los científicos por varios motivos, entre ellos que es fácil de cultivar y se puede congelar durante largos periodos de tiempo. El experimento sigue en marcha hoy día, más de 30 años más tarde. Cada día Lenski y su equipo renuevan el sustrato de glucosa y citrato de las 12 poblaciones, y cada 75 días almacenan una muestra en el congelador a -80 C. Es interesante el aspecto experimental: en cualquier momento pueden volver atrás sacando una muestra y reviviéndola, o seguirle la pista a las mutaciones secuenciando el genoma de una población en varios momentos. Es difícil imaginarse la disciplina requerida, y el propio científico nos cuenta que ha habido múltiples errores experimentales que por fortuna se han podido resolver.
El resultado más espectacular es una mutación concreta que le permitió a una población de E. coli alimentarse del citrato presente en el sustrato. Normalmente estas bacterias aprovechan sólo la glucosa, pero cuando están metidas en frascos resulta muy ventajoso aprovechar el medio al máximo.

🧼 Control bacteriano
No hay mejor forma de controlar el nivel de bacterias que el jabón: hace 150 años que Semmelweis insistió en que los médicos se lavaran las manos tras una necropsia y antes de traer un bebé al mundo, reduciendo la mortalidad por sepsis del 22% al 3%. Seguro que has visto jabones anunciados que matan el 99.9% de las bacterias. Suena bien, ¿no? El único problema es la replicación exponencial.
Tomemos el tiempo de replicación más conservador de una hora para E. coli. Tenemos las manos sucias y nos las lavamos con jabón que elimina el 99.9% de las bacterias, ¿cuánto tiempo tardamos en volver a tener las mismas bacterias que al principio? Fácil: unas 10 horas. O dicho de otra forma, ni una noche entera.

Seguir añadiendo nueves no nos protege demasiado tiempo más: cada nueve sólo añade tres horas y veinte minutos. Incluso un jabón que elimine el 99.999% de las bacterias nos dejará las manos exactamente igual tras unas 17 horitas. Preocuparse en este punto puede parecer exagerado, pero ¿quién quiere que las manos de un cirujano tras una operación larga y compleja vuelvan a estar como al llegar de la calle? Así que es mejor confiar en que los jabones tendrán algún tipo de efecto que retarde el crecimiento.
🛡️ Nuestras defensas
¿Cómo nos defendemos de esta replicación tan rápida? Vamos a ahondar en algunos aspectos del increíble sistema inmune humano.
🐖 Zoonosis
Este término ha cobrado especial relevancia tras la pandemia de COVID-19, pero el fenómeno está con nosotros desde que existimos como especie.
El ser humano se encuentra en un lugar muy interesante desde el punto de vista inmune. Los animales salvajes suelen vivir en un ecosistema limitado, y sólo tienen que tratar con cierto número de especies que les puedan contagiar enfermedades. Nosotros, por el contrario, nos movemos habitualmente entre ecosistemas, hemos domesticado múltiples especies, y además tenemos contacto frecuente entre casi todas sus subpoblaciones. Por eso el sistema inmune humano es el más complejo que conocemos.
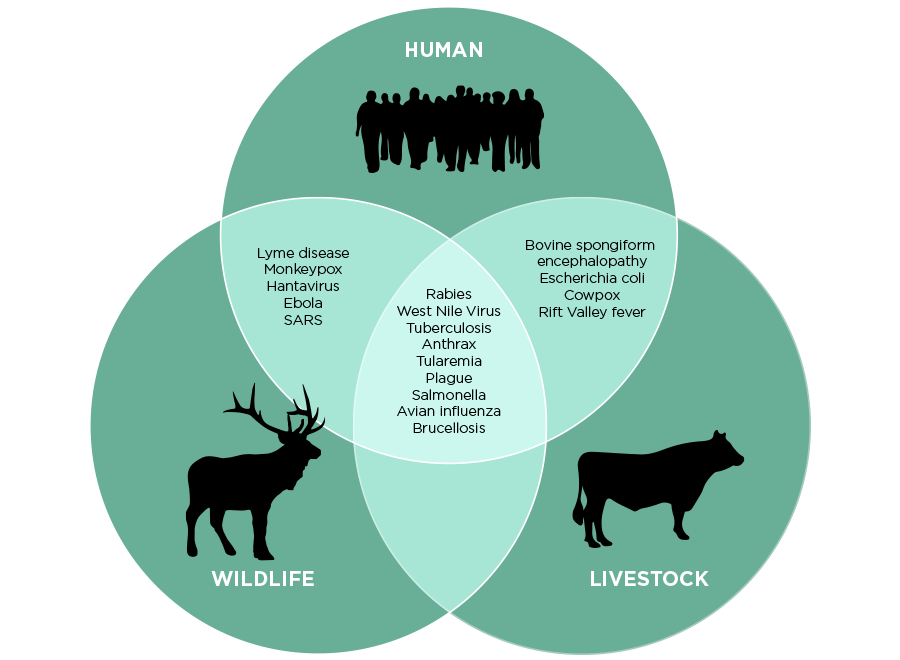
Alrededor del 60% de las enfermedades humanas son de transmisión zoonótica, es decir que se transmiten de animales a seres humanos. Y muchas de éstas provienen de fauna salvaje, como el virus del ébola que proviene del murciélago de la fruta.
El vínculo entre una enfermedad y su origen no siempre es fácil de encontrar. Todavía no se ha descubierto el origen de la reciente infección de coronavirus, aunque es probable que sea también zoonótica. Como es lógico, las enfermedades zoonóticas no suelen causar síntomas en sus huéspedes naturales.
Durante la conquista de América, los españoles e ingleses jugaron a su favor con enfermedades como la viruela, que causaron una mortalidad de entre el 40% y el 90%. Hay múltiples informes de infecciones premeditadas. Los europeos contaban con inmunidad adquirida durante muchos siglos, mientras que los americanos no. Podemos preguntarnos por qué murió gran parte de la población, pero una pregunta más interesante a mi parecer es: ¿por qué sobrevivió el resto? Gracias a la inmensa versatilidad de nuestro sistema inmune.
🎲 Jugando a los dados
Virus, bacterias, y otros microorganismos especializados en atacarnos. ¿Qué posibilidades tenemos de defendernos ante estas maquinarias diabólicas? Nuestra mejor opción parece ser jugar a los dados.
La generación de números aleatorios juega un papel muy importante en criptografía y en otras áreas. Hay multitud de ataques basados en la predictibilidad de los números generados. (Sí, predictibilidad es la palabra correcta, que lo acabo de mirar.)
Pues bien: nuestro sistema inmune también depende de la generación de números aleatorios. Las células B son un tipo de linfocitos esenciales para el sistema inmune. Cada célula B se genera aleatoriamente de un repertorio de trozos de ADN presente en nuestro genoma.
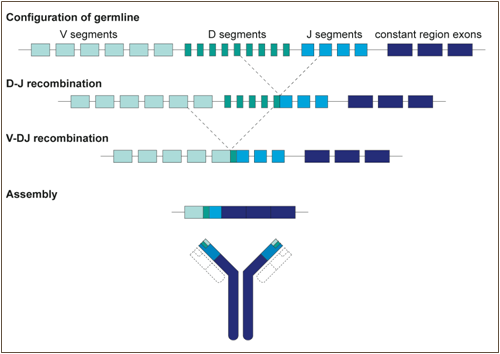
Cuando la célula B se encuentra con un antígeno, su configuración única de inmunoglobulina le da una cierta probabilidad de que lo reconozca como patógeno. Si es así los antígenos llegan a un ganglio linfático, donde empieza un proceso conocido como hipermutación somática: las células B se reproducen a toda pastilla, los genes que generan la inmunoglobulina mutan rápidamente, y sólo aquellas células que mejor reconozcan el antígeno sobrevivirán.
Las células B más aptas empiezan a generar anticuerpos en el ganglio como si no hubiera un mañana, y si el proceso funciona actúan frenando la invasión. Es un proceso con varias componentes aleatorias que lo hace difícil de predecir, pero a la vez altamente efectivo.
Lo mejor de todo es que algunas células B ya afinadas quedarán rondando en los ganglios; ante una nueva invasión del mismo antígeno la respuesta inmune será mucho más rápida, ya que estas células estarán listas para producir antígenos enseguida.
🧪 La vida de una célula T
Las células T son otro tipo de linfocitos que tienen una vida incluso más apasionante, que funcionan gracias a un sistema de pruebas muy exhaustivo que enorgullecería a la empresa de desarrollo más madura.
Se generan en la médula ósea. Al igual que las células B, su fenotipo se elige al azar siguiendo un proceso estocástico; pero cada célula T es capaz de reconocer múltiples antígenos al mismo tiempo. A continuación viajan al timo, órgano de curioso nombre situado en el esternón, donde pasan una batería de pruebas terrible: deben reconocer ciertos antígenos, pero al mismo tiempo no deben activarse ante las moléculas propias del organismo. Se calcula que se destruye alrededor del 95% de células T por fallar en estas pruebas.
Tras su maduración las células T viajarán por todo el cuerpo, entre los nodos linfáticos y la sangre, intentando detectar a células que generen patógenos. El proceso es muy curioso: las células T son como policías que piden la documentación a cada célula que se encuentran. Para cada una reclaman ver muestras de las proteínas generadas, y las comparan con su repertorio de antígenos. De esta forma son capaces de detectar células infectadas que están generando proteínas de virus o bacterias, o células cancerosas con el genoma dañado. Si encuentran alguna proteína sospechosa son capaces de destruir rápidamente la célula portadora. Pero también pueden llevar muestras de estos antígenos a los nodos linfáticos, donde las células B les ayudarán a generar anticuerpos.
En el siguiente vídeo vemos cómo una célula T reconoce un patógeno.
Hay muchos otros componentes de la respuesta inmune: unos que la refuerzan y otros que ayudan a evitar falsos positivos. Sólo de glóbulos blancos hay hay al menos 9 tipos, y múltiples subtipos.
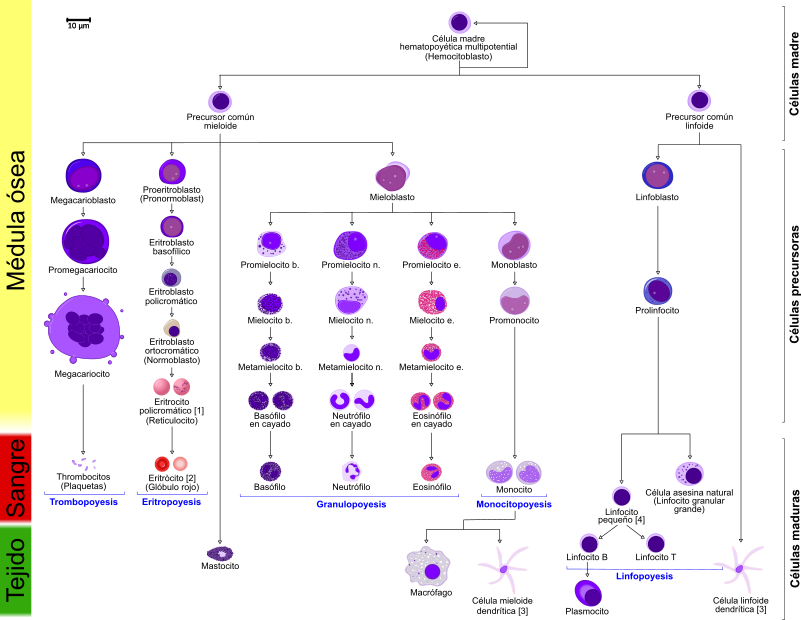
Además hay múltiples órganos implicados. Recomiendo encarecidamente esta introducción al sistema inmune de donde he sacado la información básica para este apartado; es un tema apasionante y en el que, literalmente, nos jugamos la vida.
💑 Atracción fetal
La atracción en una pareja parece relacionada con el complejo mayor de histocompatibilidad (CMH, o MHC en inglés). Se han hecho experimentos para comprobar las preferencias en olor corporal, y se ha comprobado que nos atrae el olor de gente con CMH diferente al nuestro. De hecho tenemos un órgano especializado sólo para eso en el cuerpo: el órgano vomeronasal, aunque no está claro que sea funcional en humanos. Curiosamente en las pruebas no se detectaron diferencias entre hombres y mujeres: en lo que respecta al olfato, ambos sexos se veían igualmente atraídos hacia el propio o el ajeno.

También la satisfacción sexual de una pareja está correlacionada con la diferencia en CMH. Además se ha observado que la probabilidad de aborto espontáneo crece para parejas con compatibilidad en el CMH. Todo el proceso está orientado a generar progenie con mayor variedad en el CMH, lo que se supone que los hará más resistentes a infecciones.
Por cierto que las secreciones corporales (que incluyen las ya famosas feromonas) son inodoras; sólo tras la descomposición por la flora bacteriana de la piel adquieren su peculiar olor y su capacidad para atraer a posibles compañeros sexuales. Así que, muy literalmente, dependemos de las bacterias incluso para aparearnos.
🔬 La ciencia al rescate
Pese a la maravillosa efectividad del sistema inmune, muchas infecciones consiguen burlarlo. ¿Qué aporta la ciencia a nuestras defensas?
🧫 Antibióticos
Hoy en día nuestra primera línea de defensa ante las bacterias son los antibióticos. ¿Cómo se descubrieron?
Corría el año 1928. El doctor Alexander Fleming volvió de vacaciones para encontrarse una cápsula de Petri contaminada por bacterias y hongos. Podemos suponer que debe ser una ocurrencia habitual en un laboratorio, pero Fleming se dedicó a investigar el fenómeno en profundidad. Suele decirse que la penicilina se descubrió por casualidad, pero no creo que sea una caracterización correcta: sin la tenacidad del investigador no se habría dado cuenta de que las secreciones de cierta cepa del hongo Penicillium mataban a las bacterias de alrededor, como les había pasado a todos los investigadores antes de él.
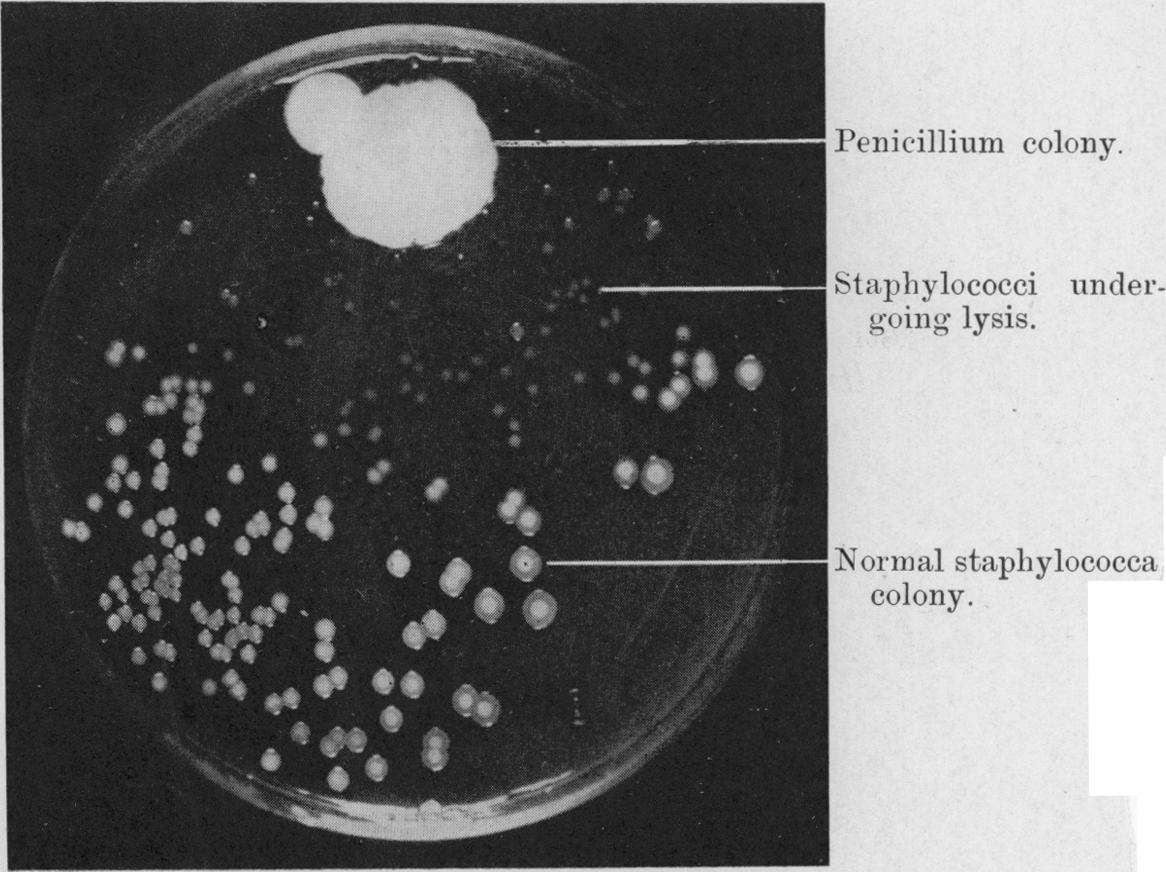
Fleming publicó sus resultados y la cosa quedó ahí, como una curiosidad científica. Pero otros investigadores siguieron con el trabajo incansable de refinar el proceso y aumentar el rendimiento. Con la llegada de la segunda guerra mundial los Estados Unidos se unieron a la investigación. Fue Mary Hunt, una asistente de laboratorio estadounidense, quien encontró el melón mohoso que cambiaría la historia. La hermosa cepa dorada que contenía el melón era 1000 veces más potente que la de Fleming, y permitió la producción en masa de penicilina.
Por desgracia ya vimos en la parte 2 la facilidad que tienen las bacterias para transferir genes entre ellas. Cuando se trata una enfermedad con un antibiótico es fácil que las bacterias benéficas del intestino se vuelvan resistentes, y pueden transferir esa inmunidad a otras bacterias patógenas. Fleming ya advirtió del peligro de abusar de los antibióticos en su discurso de aceptación del premio Nobel.
Hoy día tenemos una gran variedad de antibióticos, pero la situación empeora rápidamente, hasta el punto de que la Organización Mundial de la Salud ha solicitado acción urgente. Sobre todo en el tercer mundo la sobremedicación está fuera de control, lo que hace que los antibióticos estén perdiendo eficacia a ojos vista. Es necesario emplear técnicas de big data que permitan descubrir rápidamente a qué antibióticos es resistente una cepa, y poner así el tratamiento adecuado lo antes posible.
🥼 Ensayos clínicos
La forma que tiene la ciencia médica de conseguir nuevos antibióticos, y en general nuevas medicinas, es a través de ensayos clínicos. Se trata de un proceso riguroso que incluye al menos tres fases: en la primera se comprueba que el medicamento sea seguro en voluntarios, y en la segunda se verifica su eficacia en pacientes. La fase III es la más completa, implica a más pacientes todavía (cientos o miles), y suele hacerse con un proceso de doble ciego: se trata a la mitad de los pacientes con el medicamento, y la otra mitad sólo recibe un placebo sin efecto. Ni pacientes ni investigadores saben en qué grupo está cada uno.
El problema en este caso es justamente el coste. Sólo la fase III puede costar alrededor de $20 millones de dólares. Y básicamente se consigue un bit de información: si funciona el medicamento X para la enfermedad Y o no. ¿Quién está dispuesto a pagar esta cantidad? Sólo los gobiernos y las grandes farmacéuticas pueden hacer este tipo de inversión. Y desde hace tiempo los gobiernos han delegado en la empresa privada los ensayos clínicos.
🧬 Edición de genes
Podemos ir un paso más allá. El viejo sueño de editar genes in vivo permitiría añadir o quitar proteínas de un organismo directamente. Es un sueño para cualquier investigador, y por supuesto podría resultar en terapias novedosas para enfermedades genéticas. Así que, ¿cómo podríamos hacer cambios en el genoma de seres vivos?

Resulta que estas “tijeras genéticas” se encontraron ya listas para usar, cómo no, en bacterias y arqueas. Vamos a irnos esta vez a España en 1993, para ser exactos a las salinas de Santa Pola en Alicante. El investigador español Francisco Mojica estudiaba la arquea halofílica Haloferax mediterranei, un extremófilo que sobrevive a salinidades extremas. Encontró unas secuencias repetidas y empezó a investigar su función. En 2000 localizó secuencias similares en muchas bacterias y arqueas, y las llamó CRISPR (clustered regularly interspaced short palindromic repeats). Y en 2003 descubrió que muchas secuencias misteriosas contenían segmentos de genes de virus, lo que le llevó a postular que se trataba de un sistema inmune adaptativo. No consiguió publicar su descubrimiento hasta dos años después.
Su teoría se confirmó en 2010. CRISPR forma parte del sistema inmune procariota, y sirve para defenderse de bacteriófagos y otros virus: toman trocitos de ADN invasor y lo colocan en sitios especiales que son dianas para la degradación selectiva. Ante posteriores invasiones la procariota detectará y eliminará los genes localizados.
Muchos otros investigadores dieron con piezas del puzzle. Seguramente las más importantes sean Charpentier (francesa) y Doudna (estadounidense): mostraron cómo la proteína Cas9 se puede usar como tijeras genéticas. De ahí que el nombre completo de la técnica sea CRISPR/Cas9. Hoy día se usa para editar genes de organismos in situ y añadir proteínas que falten o no sean funcionales. Esta técnica puede usarse por ejemplo para tratar diversos tipos de cáncer, inmunoterapia y para muchas otras aplicaciones. El siguiente vídeo muestra cómo funciona.
Esta técnica es muy prometedora también en la lucha contra las infecciones, y puede servir por ejemplo para reforzar las defensas de pacientes contra bacterias resistentes a los antibióticos. Incluso se ha usado para almacenar datos en el genoma bacteriano. Pero es pronto todavía para ver sus efectos.
Mientras tanto, en 2019 Mojica no tenía prisa por ganar un premio Nobel, y en 2020 Charpentier y Doudna ganaron el Nobel de química cuando inevitablemente se concedió por estos descubrimientos. Ya hemos visto que fue una elección merecidísima, aunque en mi humilde opinión habría sido de justicia honrar también al investigador español por su descubrimiento original.
☠️ Matar al anfitrión
En todo este artículo estamos asumiendo que las bacterias intentan activamente asesinarnos de cualquier forma. Y esto no es tan cierto como pensamos. La lógica es sencilla: si el huésped mata al anfitrión se le acaba el chollo rápidamente. Puede después pasar a otro anfitrión, pero si también lo mata, la cadena sigue hasta que se quede sin anfitriones y termine desapareciendo. ¡Mala estrategia de supervivencia! Tampoco les interesa realmente dañar los tejidos en los que se alojan.
Los virus no pueden reproducirse por sí solos: necesitan maquinaria celular de la que carecen. En palabras del virólogo español Luis Enjuanes a propósito del famoso SARS-CoV-2:
lo usual con este tipo de virus es que evolucionen y se seleccionen muy positivamente aquellos que están más atenuados. Esto ocurre por una razón muy sencilla. Si un virus es muy mortal, mata pronto al paciente y se quita de la circulación. En el lado contrario, si un virus está amortiguado e infecta al paciente pero no provoca síntomas clínicos, este sigue con su vida normal y disemina el virus. Así se facilita que sea este el que se imponga, claro.
Este párrafo ha sido profético con la variante Ómicron.
Tampoco pueden reproducirse por sí solas algunas bacterias, que usan los mecanismos de las celulas que infectan; ya hemos visto el caso de Mycobacterium leprae, la bacteria que causa la lepra. No es lo más habitual: la mayoría de las bacterias son autosuficientes. Al menos hasta que pueden permitirse no serlo porque el medio donde viven cubra sus necesidades. Pero si se dedican a matar a sus anfitriones, ¿dónde van a sobrevivir?

🖇️ Simbiosis
Lo que sí que van a intentar todas las bacterias es pasar desapercibidas: en el momento que el sistema inmune del anfitrión las detecte sus probabilidades disminuyen. La mejor estrategia a largo plazo es siempre la simbiosis: huésped y anfitrión crecen y se apoyan mutuamente. La lógica es sencilla: supongamos una bacteria que infecta a un humano y le confiere una ventaja evolutiva. Si humano + bacteria es mejor que humano solo, entonces la bacteria medrará a lomos de su anfitrión humano. La patogénesis es inestable en el tiempo:
- patógeno o huésped vulnerable terminarán adaptándose uno a otro,
- o bien el huésped desarrollará inmunidad,
- o ambos desaparecerán.
Este proceso nos da un respiro: las bacterias tienen unas capacidades maravillosas, pero realmente no quieren matarnos. De hecho les viene mejor ayudarnos, como vemos en todo nuestro entorno: sin ellas no seríamos capaces de hacer cerveza, digerir la comida, o ni siquiera reproducirnos.
A lo que realmente tendríamos que aspirar no es a aniquilar todas las bacterias, sino a convivir con ellas y con los demás microorganismos en las mejores condiciones posibles. Este cambio de mentalidad urge en un planeta cada vez más deteriorado por nuestra loca lucha contra todo lo que no nos es útil directamente.
⏭️ Continuará…
Este artículo es la tercera parte de la serie sobre bacterias. Sigue a la parte 4: Enfermedades autoinmunes donde hablaremos de patologías que afectan directamente al sistema inmune.
← Parte 1: 🦠 Y las bacterias,
bonita.
← Parte 2: ⚙️ Tecnología
bacteriana.
↑ Parte 3: 🖇️ El largo camino a la simbiosis.
→ Parte 4: 🧑⚕️ Enfermedades
autoinmunes.
→ Parte 5: 🌠 ¿Venimos de las
estrellas?
→ Parte 6: 🤔
Conclusiones.
Publicado el 2022-06-27, modificado el 2023-02-05. ¿Comentarios, sugerencias?
Back to the index.